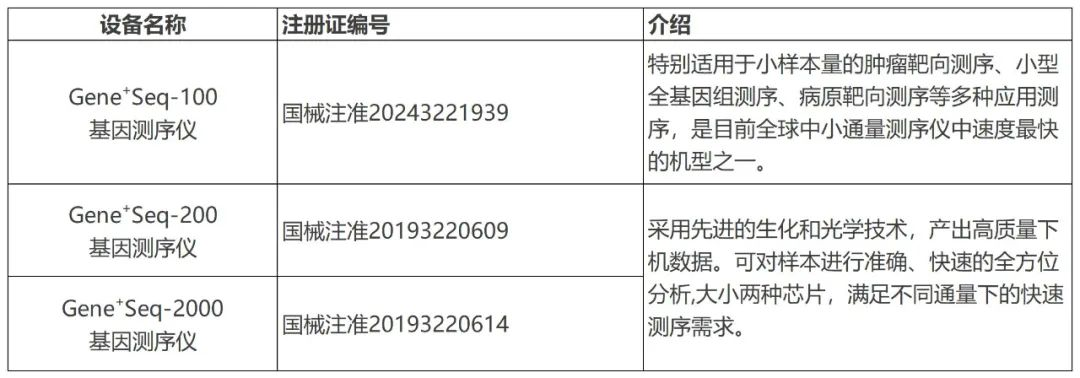
Pril药物特利加压素注射液获得CBG销售许可证
2月24日,德奇制药宣布,国家药监局授予全球首个选择性核出口抑制剂(sine)atg-010(selenexor,xpovio?)治疗难治性和复发性多发性骨髓瘤(RRMM)的新药申请(NDA)优先资格。
atg-010是世界上第一个被批准的正弦化合物,它能诱导肿瘤抑制蛋白和其他生长调节蛋白在细胞核内的滞留和活化,下调细胞质中各种致癌蛋白的水平,在不影响正常细胞的情况下,在体内外诱导肿瘤细胞凋亡。作为创新疗法,美国食品和药物管理局(FDA)在18个月内批准atg-010(selinexor)治疗三种血肿适应症。同时,atg-010治疗多发性骨髓瘤和弥漫性大B细胞淋巴瘤被纳入国家综合癌症网络(NCCN)指南。德奇完成了中国大陆患者的临床试验,并在过去6个月内提交了亚太市场的新药申请,包括澳大利亚、韩国和新加坡。

Atg-010为难治性和复发性多发性骨髓瘤的治疗提供了新的思路。我们很高兴该产品已被国家海洋保护局优先审查。Atg-010作用于xpo1,xpo1是唯一经临床证实的核输出蛋白靶点,有潜力满足血肿和实体瘤的巨大临床需求。”德奇医药创始人、董事长兼首席执行官梅建明博士说:“到目前为止,难治性和复发性多发性骨髓瘤仍然无法治愈。我很高兴有更多的病人能尽快接受atg-010治疗。我们期待通过与监管部门的密切沟通与合作,推动atg-010上市。”
为加快具有重要临床价值药品的注册和研究,国家药品监督管理局于2020年7月7日实施《药品经营许可证优先审批程序(试行)》。在这一程序的有效实施下,审批部门将加快具有优先评审资格的临床新药的评审和审批,让中国患者尽快共享新疗法。
关于atg-010(selinexor,xpovio)
atg-010(selinexor,xpovio)是第一个也是唯一一个口服选择性核输出抑制剂(sine),由karyopharm therapeutics Inc.开发,德奇制药研究。德奇医药在大中华区、韩国、澳大利亚、新西兰和东盟国家等亚太地区市场取得了atg-010的独家开发和商业化权利。
2019年7月,美国食品和药物管理局(FDA)批准了selinexor(xpovio?)联合小剂量地塞米松治疗难治性复发性多发性骨髓瘤。2020年6月,美国FDA重新批准了selinexor(xpovio?)作为单一药物治疗难治性和复发性弥漫性大B细胞淋巴瘤(rrdlbcl)。2020年12月,美国FDA批准了selenexor(xpovio?)联合硼替佐米和地塞米松治疗过去至少接受过治疗方案的多发性骨髓瘤患者。已向欧洲药品管理局(EMA)提交了一份销售授权申请(MAA),以有条件批准selinexor的RRMM适应症。选择(xpovio?)是FDA批准的第一个也是唯一一个口服正弦化合物。它也是第一个可以用来治疗多发性骨髓瘤和弥漫性大B细胞淋巴瘤的药物。另外,selinexor(xpovio?)已经进行了多个实体瘤适应症的中晚期临床试验,包括脂肪肉瘤和子宫内膜癌。2020年11月,德齐制药合作伙伴karyopharm在2020年结缔组织癌年会(CTOs 2020)上报告了3期seal试验的阳性数据。Seal是一项随机、双盲、安慰剂对照、交叉试验,旨在比较口服塞林克索(xpovio?)的疗效脂肪肉瘤患者与安慰剂的比较。此外,karyopharm宣布正在进行的selinexor(xpovio?)用于治疗子宫内膜癌患者。计划的中期无效性分析已经完成。数据安全监测委员会(DSMB)建议试验应继续进行,不作任何修改。西恩多试验的主要数据结果预计将在2021年下半年公布。